Pentru o minte informată într-un corp sănătos
Au trecut vaccinurile Pfizer-BioNTech, Moderna și Oxford-AstraZeneca prin aceleași proceduri de verificare ca restul vaccinurilor aflate pe piață?
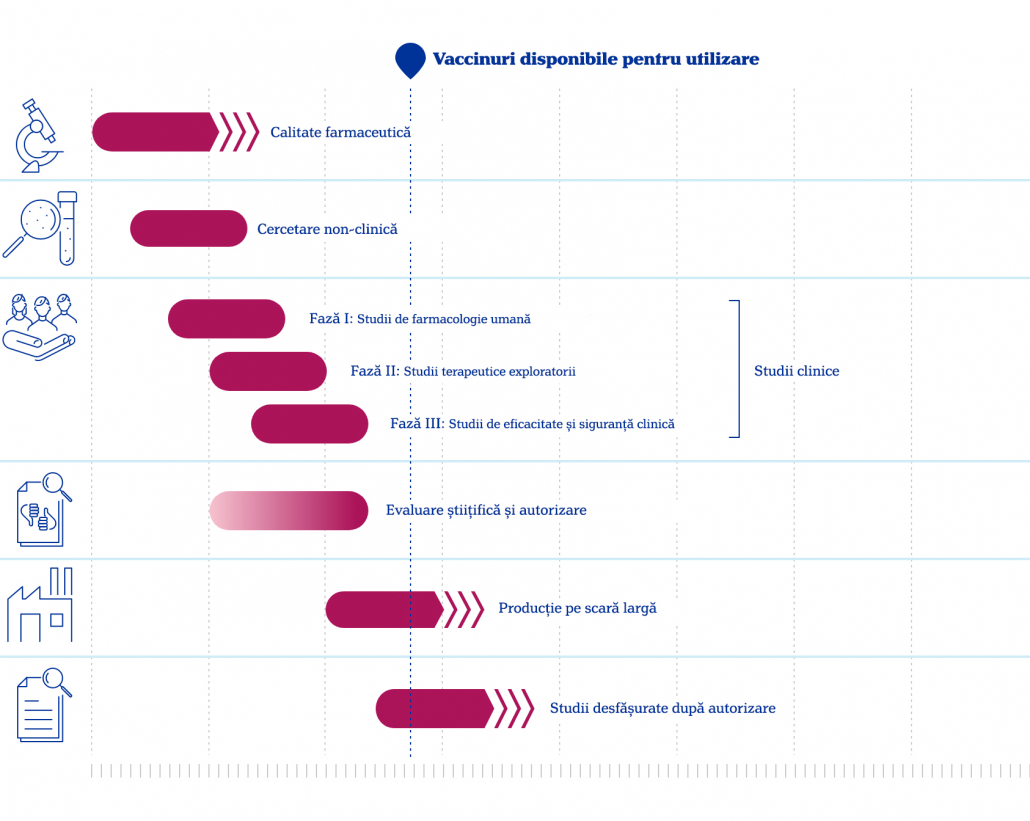
Vaccinurile împotriva COVID-19 au trecut prin procedurile normale de verificare, însă, din nevoia de a obține rezultate cât mai clare și rapide, unele etape s-au suprapus, scurtând astfel durata până la avizare.
Orice medicament sau vaccin trece printr-o succesiune de teste riguroase înainte să fie aprobat. Pentru vaccinurile anti-COVID-19, această verificare s-a făcut constant, pe toată durata dezvoltării lor. Etapele normale de cercetare sunt în general decalate, însă, din cauza situației pandemice, a fost necesar ca acele etape să fie suprapuse (1,2).
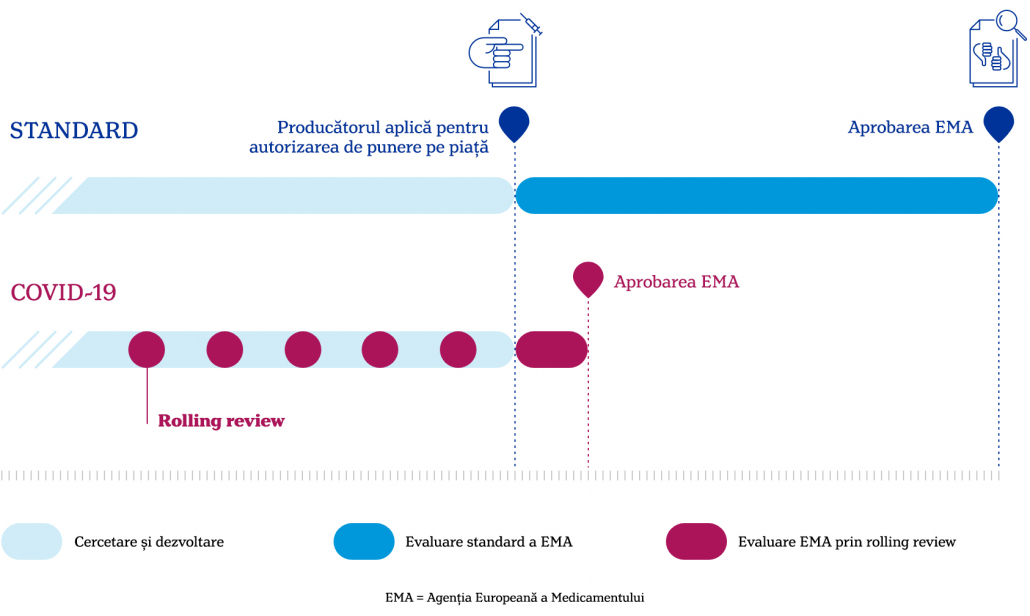
Datele din studiile pentru vaccinurile anti-COVID-19 au fost raportate în permanență către Agenția Europeană a Medicamentului (EMA), autoritatea care se ocupă de autorizarea de punere pe piață a medicamentelor prin Procedura Centralizată. Astfel, când datele studiilor clinice au fost disponibile, EMA a avut nevoie de o perioadă mai scurtă pentru a decide dacă vaccinul respectiv este sigur sau nu (3).
Chiar și în aceste condiții, cercetarea nu a pornit de la zero, tehnologia ARN-ului mesager, folosită în cazul vaccinurilor Pfizer BioNTech și Moderna, fiind cunoscută de aproximativ trei decenii (4). Vaccinul produs de Astra Zeneca folosește o tehnologie diferită – vector viral -, care la rândul ei a fost studiată îndelung (5). În plus, cunoștințele medicale legate de coronavirusuri au fost suficient de dezvoltate încât să permită demararea rapidă a cercetării.
În concluzie, deși durata a fost scurtă (sub 1 an), vaccinurile anti-COVID-19 au fost verificate la fel de riguros ca orice alte vaccinuri. De pildă, primul vaccin pentru oreion a fost aprobat în 1967, după 4 ani de la începerea cercetării în domeniu, cu tehnologie rudimentară, iar acel vaccin se folosește și azi (6).
Date verificate și confirmate de ANMDMR în baza solicitării 50739/21.01.2021.
Surse:
- Commissioner O of the. The Drug Development Process [Internet]. FDA. FDA; 2020 [cited 2021 Jan]. Available from: https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process
- DIMITROVA EK. EMA starts second rolling review of a COVID-19 vaccine [Internet]. European Medicines Agency. 2020 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/news/ema-starts-second-rolling-review-covid-19-vaccine
- GLANVILLE D. Treatments and vaccines for COVID-19: medicines under evaluation [Internet]. European Medicines Agency. 2021 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/treatments-vaccines-covid-19-medicines-under-evaluation
- Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines — a new era in vaccinology. Nature Reviews Drug Discovery. 2018 Apr;17(4):261–79.
- Majhen D, Calderon H, Chandra N, Fajardo CA, Rajan A, Alemany R, et al. Adenovirus-based vaccines for fighting infectious diseases and cancer: progress in the field. Hum Gene Ther. 2014 Apr;25(4):301–17.
- Roos D. How a New Vaccine Was Developed in Record Time in the 1960s [Internet]. HISTORY. [cited 2021 Jan]. Available from: https://www.history.com/news/mumps-vaccine-world-war-ii
Vrei să știi mai multe?
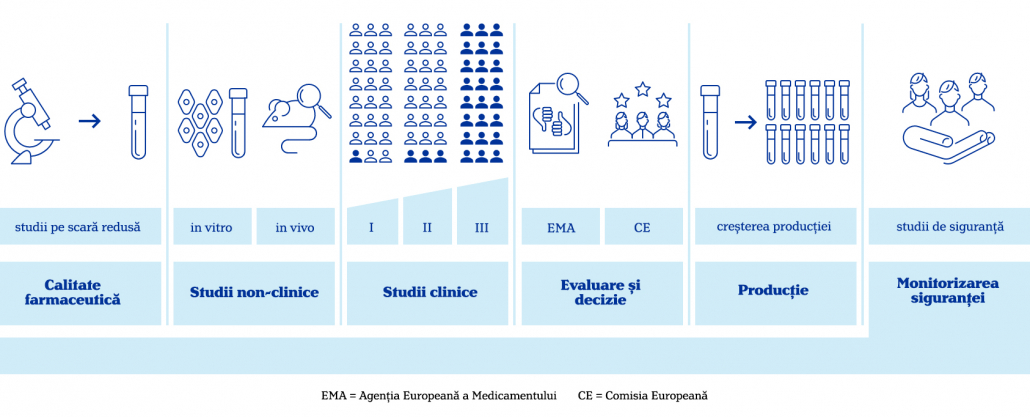
Vaccinurile, ca orice medicament, necesită o serie de teste clinice pentru a putea fi folosite pe scară largă. Pentru ca un vaccin sau orice fel de medicament să ajungă pe piață, el trebuie să treacă printr-o serie de teste riguroase.
Sursa foto: www.ema.europa.eu
Întâi, companiile producătoare realizează cercetări pentru a determina formula farmaceutică potrivită și pentru a verifica condițiile la care componentele rămân stabile.
Urmează teste realizate în laborator (in vitro) sau pe animale (in vivo) care urmăresc reacțiile adverse, toxicitatea și – în cazul vaccinurilor – dacă determină răspuns imun.
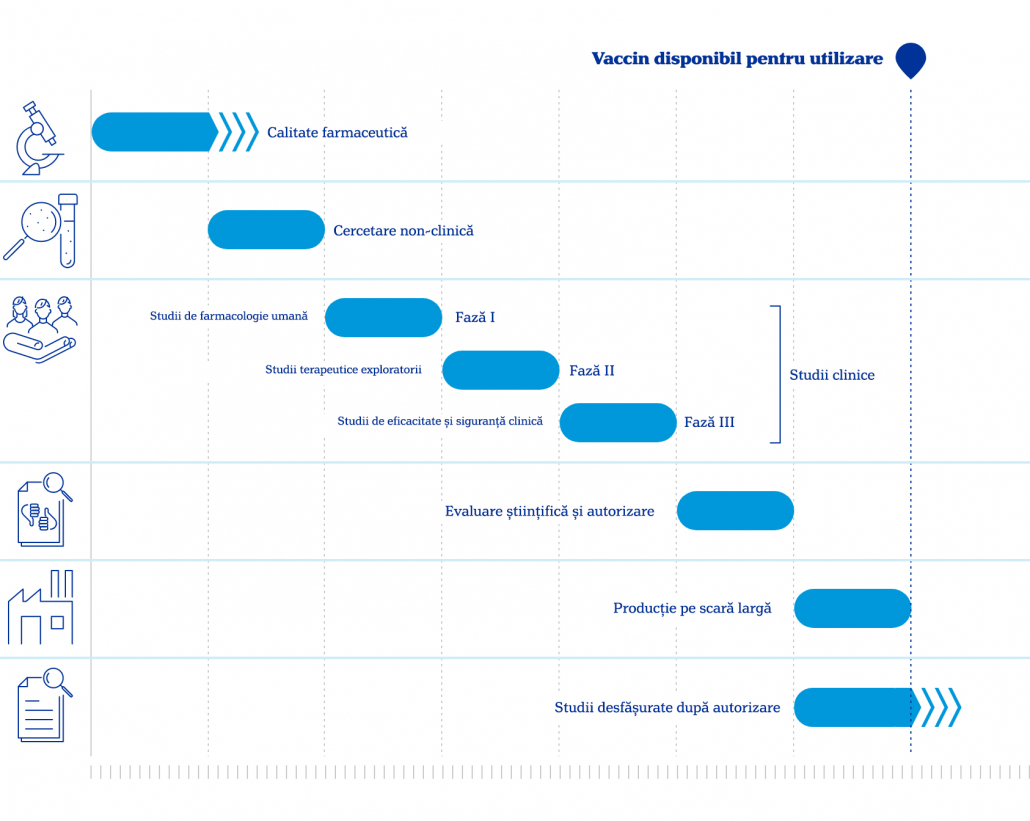
În cele din urmă, substanța ajunge în etapa studiilor clinice. Acestea se împart în studii clinice de fază I, II și III.
- Studiile de fază I includ între 20 și 100 de voluntari sănătoși cu scopul de a calcula doza potrivită care generează răspuns imun, dar care nu este toxică.
- Studiile de fază II includ câteva sute de voluntari pentru a urmări cele mai comune efecte adverse și dacă răspunsul imun persistă și în acest grup.
- Studiile de fază III includ mii de voluntari, de vârste și condiții fizice cât mai diverse. În cadrul acestora, o jumătate din voluntari primesc vaccinul, iar cealaltă jumătate primesc placebo. Astfel, este determinată eficiența vaccinului, dar și efectele adverse mai puțin frecvente (având în vedere numărul mult mai mare de participanți) (1)
Ulterior, medicamentele și vaccinurile puse pe piață sunt verificate în permanență.
În mod uzual, o nouă etapă în testare începe când cea precedentă s-a incheiat.
Sursa foto: www.ema.europa.eu
În situații de criză sanitară, cum a fost pandemia de COVID-19, etapele aproape că se suprapun, tocmai pentru a urgenta dezvoltarea unui vaccin eficient (2).
Sursa foto: www.ema.europa.eu
Majoritatea noilor medicamente (inclusiv vaccinurile) nu reușesc să treacă de toate etapele necesare pentru a fi puse pe piață – sub 10% din medicamentele aflate în cercetare ajung să parcurgă întreg procesul de aprobare, de la studiile clinice și până la comercializare (3,4).
La nivelul Uniunii Europene, Agenția Europeană a Medicamentului (EMA) este organismul de control și reglementare pentru orice medicament care urmează a fi folosit în statele din spațiul comunitar. Cu alte cuvinte, niciun medicament nu poate fi folosit în spațiul UE decât cu aprobarea EMA.
La începutul pandemiei, la nivelul Uniunii Europene s-a propus o procedură prin care potențialele vaccinuri să poată fi livrate și folosite de către statele membre, după ce EMA decide dacă sunt sigure și eficiente (5,6).
Pe langă succesiunea extrem de rapidă a studiilor de laborator și clinice, în cazul vaccinurilor anti COVID-19 aprobate până în prezent, o serie de alți factori au influențat punerea lor pe piață într-un timp atât de scurt.
În primul rând, EMA a putut să evalueze cu rapiditate vaccinurile împotriva COVID-19 datorită unui mecanism denumit „rolling review” care este activat în situații de criză sanitară. Acesta presupune analizarea datelor din studii pe bucăți, pe măsură ce ele se desfășoară, înainte să fie depusă cererea finală de autorizație. Altfel, în situații obișnuite, Agenția Europeană a Medicamentului nu ar fi avut acces la niciun fel de date până când producătorul nu ar fi depus cererea de autorizare. Prin această metodă, EMA a putut analiza datele pe măsură ce ele veneau de la producător (7,8).
Sursa foto: www.ema.europa.eu
În al doilea rând, vaccinurile Pfizer-BioNTech, Moderna și Oxford-AstraZeneca au fost aprobate printr-o procedură specială, numită Aprobare Condiționată – CMA (Coditional Marketing Authorisation). Prin această procedură, care a mai fost folosită și în alte cazuri, Comisia Europeană, la recomandarea Agenției, poate acorda autorizația pentru ca un anumit medicament să fie pus pe piață în statele membre, însă doar dacă medicamentul respectiv îndeplinește anumite condiții: raportul risc-beneficiu este clar pozitiv, producătorul va continua să furnizeze date după acordarea autorizației, medicamentul acoperă o nevoie medicală urgentă, beneficiul disponibilității imediate este mai mare decât riscurile posibile și inerent absenței unor date clinice complete (9-11).
Un medicament aprobat prin această procedură va beneficia de posibilitatea de a fi comercializat și folosit în spațiul comunitar pentru un an, aprobarea putând fi ulterior înnoită doar dacă anumite condiții sunt îndeplinite. Dacă oricând pe parcursul autorizației, se demonstrează că medicamentul nu este sigur sau eficient, acesta va fi imediat retras de pe piață.
La 11 Decembrie 2020, alte 24 medicamente erau aprobate de către EMA prin procedura de Autorizare Condiționată de Comercializare, pentru uz în spațiul comunitar. E vorba de substanțe folosite în tratamentele oncologice, medicamente împotriva tuberculozei, terapii cu celule stem pentru arsuri și medicamente pentru distrofiile musculare ale copiilor (12).
Suplimentar, în ceea ce privește disponibilitatea către publicul larg a raportărilor de reacții adverse (eventuale rezumate/centralizări ale acestora), conform condițiilor prevăzute în autorizația de punere pe piață, Deținătorul Autorizației de Punere pe Piață al vaccinurilor va prezenta către EMA, spre evaluare, un prim Raport Periodic Actualizat privind Siguranța în termen de 6 luni de la autorizare.
În acest raport sunt centralizate toate datele disponibile acumulate de la momentul autorizării produsului, inclusiv rapoartele de reacții adverse.
Având în vedere că vaccinurile anti-COVID-19 sunt produse cu autorizare centralizată, EMA va decide ulterior publicarea informațiilor.
În plus, informații privind reacțiile adverse raportate la nivel european pentru toate medicamentele, inclusiv pentru vaccinurile anti-COVID-19, sunt disponibile pe website-ul pus la dispoziție de EMA (www.adrreports.eu), mai multe rapoarte fiind disponibile pentru vizualizare. Astfel, profesioniștii din domeniul sănătății și pacienții au acces permanent la cele mai noi informații privind reacțiile adverse raportate în statele membre ale Uniunii Europene. Persoanele vaccinate în România pot raporta eventualele reacții adverse aici: https://covid19.anm.ro/.
În al treilea rând, vaccinurile bazate pe tehnologia ARN-ului mesager nu sunt o necunoscută, așa cum susțin unele voci din spațiul public. Tehnologia este descrisă și utilizată în cercetare încă din anii 1990. Până la acest moment a fost folosită în cercetare, pentru crearea unor vaccinuri împotriva gripei, virusului Zika, rabiei și HIV, dar și pentru tratamente oncologice. Aceste proiecte nu au trecut mai departe de anumite stadii, din cauza lipsei de finanțare (13).
Cu alte cuvinte, la această tehnologie se lucrează de aproape trei decenii, însă a fost insuficient folosită.
Similar, și ideea de a folosi vectori virali în crearea unui vaccin este discutată și dezbătută de cercetători. Cu toate că studiile preliminare au arătat un potențial semnificativ pentru utilizare, atât în combaterea unor boli infecțioase, dar și în lupta împotriva cancerului, nici aceste vaccinuri nu au fost folosite pe scară largă până acum (14,15). Tehnologia vectorului viral a fost folosită în 2019 când a fost aprobat un vaccin împotriva Ebola (16).
În al patrulea rând, virusul SARS-CoV2 a fost studiat intens de la momentul izolării sale. În plus, fiind din aceeași familie cu virusurile care au produs epidemiile de SARS (2002-2004) și MERS (2012-prezent), cercetarea în cazul acestui coronavirus nu a pornit de la 0.
Atât pentru SARS, cât și pentru MERS se lucra deja la un vaccin, de la momentul descoperirii lor, fără însă a se investi suficient în acestea (17-24).
Ca atare, vaccinurile anti COVID-19 menționate au trecut prin succesiunea normală de cercetare și verificare, doar că acestea s-au suprapus, din necesitatea obținerii unor rezultate cât mai clare și rapide. În plus, acestea au fost testate în faza III pe zeci de mii de oameni, spre deosebire de vaccinurile tesate anterior, unde faza III de testare a fost aplicată unor grupuri de maxim câteva mii de persoane.
Este relevant de menționat și că vaccinurile Pfizer BioNTech, Moderna și Oxford AstraZeneca sunt în acest moment singurele aprobate la nivelul Uniunii Europene, din 238 de variante propuse de alte companii și centre de cercetare (25).
Date verificate și confirmate de ANMDMR în baza solicitării 50739/21.01.2021.
Surse:
- Commissioner O of the. The Drug Development Process [Internet]. FDA. FDA; 2020 [cited 2021 Jan]. Available from: https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process
- GLANVILLE D. COVID-19 vaccines: development, evaluation, approval and monitoring [Internet]. European Medicines Agency. 2020 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/covid-19-vaccines-development-evaluation-approval-monitoring
- Struck M-M. Vaccine R&D success rates and development times. Nat Biotechnol. 1996 May;14(5):591–3.
- Mullard A. Parsing clinical success rates. Nature Reviews Drug Discovery. 2016 Jul 1;15(7):447–447.
- HRABOVSZKI G. EMA’s governance during COVID-19 pandemic [Internet]. European Medicines Agency. 2020 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/emas-governance-during-covid-19-pandemic
- Coronavirus: Commission unveils EU vaccines strategy [Internet]. European Commission – European Commission. [cited 2021 Jan]. Available from: https://ec.europa.eu/commission/presscorner/detail/en/ip_20_1103
- GLANVILLE D. Treatments and vaccines for COVID-19: medicines under evaluation [Internet]. European Medicines Agency. 2021 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/treatments-vaccines-covid-19-medicines-under-evaluation
- DIMITROVA EK. EMA starts second rolling review of a COVID-19 vaccine [Internet]. European Medicines Agency. 2020 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/news/ema-starts-second-rolling-review-covid-19-vaccine
- Anonymous. Conditional marketing authorisation [Internet]. European Medicines Agency. 2018 [cited 2021 Jan]. Available from: https://www.ema.europa.eu/en/human-regulatory/marketing-authorisation/conditional-marketing-authorisation
- Q&A: Conditional Marketing Authorisation of COVID-19 Vaccine [Internet]. European Commission – European Commission. [cited 2021 Jan]. Available from: https://ec.europa.eu/commission/presscorner/detail/en/QANDA_20_2390
- Hoekman J, Boon WPC, Bouvy JC, Ebbers HC, de Jong JP, De Bruin ML. Use of the conditional marketing authorization pathway for oncology medicines in Europe. Clin Pharmacol Ther. 2015 Nov;98(5):534–41.
- List of medicinal products under additional monitoring. 2013;15.
- Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines — a new era in vaccinology. Nature Reviews Drug Discovery. 2018 Apr;17(4):261–79.
- Majhen D, Calderon H, Chandra N, Fajardo CA, Rajan A, Alemany R, et al. Adenovirus-based vaccines for fighting infectious diseases and cancer: progress in the field. Hum Gene Ther. 2014 Apr;25(4):301–17.
- Ura T, Okuda K, Shimada M. Developments in Viral Vector-Based Vaccines. Vaccines (Basel). 2014 Jul 29;2(3):624–41.
- First FDA-approved vaccine for the prevention of Ebola virus disease, marking a critical milestone in public health preparedness and response | FDA [Internet]. [cited 2021 Feb]. Available from: https://www.fda.gov/news-events/press-announcements/first-fda-approved-vaccine-prevention-ebola-virus-disease-marking-critical-milestone-public-health
- Carralot J-P, Probst J, Hoerr I, Scheel B, Teufel R, Jung G, et al. Polarization of immunity induced by direct injection of naked sequence-stabilized mRNA vaccines. CMLS, Cell Mol Life Sci. 2004 Sep 1;61(18):2418–24.
- Jiang S, He Y, Liu S. SARS Vaccine Development. Emerg Infect Dis. 2005 Jul;11(7):1016–20.
- See RH, Zakhartchouk AN, Petric M, Lawrence DJ, Mok CPY, Hogan RJ, et al. Comparative evaluation of two severe acute respiratory syndrome (SARS) vaccine candidates in mice challenged with SARS coronavirus. Journal of General Virology,. 2006;87(3):641–50.
- Zhou Y, Jiang S, Du L. Prospects for a MERS-CoV spike vaccine. Expert Review of Vaccines. 2018 Aug 3;17(8):677–86.
- Wang L, Shi W, Joyce MG, Modjarrad K, Zhang Y, Leung K, et al. Evaluation of candidate vaccine approaches for MERS-CoV. Nature Communications. 2015 Jul 28;6(1):7712.
- de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nature Reviews Microbiology. 2016 Aug;14(8):523–34.
- Maslow JN. Vaccines for emerging infectious diseases: Lessons from MERS coronavirus and Zika virus. Human Vaccines & Immunotherapeutics. 2017 Dec 2;13(12):2918–30.
- Liang F, Lindgren G, Lin A, Thompson EA, Ols S, Röhss J, et al. Efficient Targeting and Activation of Antigen-Presenting Cells In Vivo after Modified mRNA Vaccine Administration in Rhesus Macaques. Molecular Therapy. 2017 Dec 6;25(12):2635–47.
- Draft landscape and tracker of COVID-19 candidate vaccines [Internet]. [cited 2021 Jan]. Available from: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines